Reaksi adisi aldehid dan keton biasanya disebut dengan adisi nukleofilik. Reaksi adisi dapat dikatakan adisi ketika dimana awalnya ikatan rangkap membentuk ikatan tunggal atau tidak adanya ikatan rangkap. Aldehid dan keton memiliki sifat fisisnya yaitu kepolaran dan kelarutannya. Coba perhatikan gambar dibawah ini:
Berdasarkan dari gambar diatas bahwa aldehid dan keton memiliki atom C atau karbonil yaitu Sp2 , maka sudut yang dibentuk ROH itu adalah 120o . Seperti yang kita ketahui adalah bahwa keelektronegatifan O lebih besar dari pada keelektronegatifan C sehingga itu menjadi ikatan yang polar. Coba perhatikan perbandingan dibawah ini:
Dapat dilihat bahwa berdasarkan titik didih yang paling rendah adalah alkana dan titik didih yang paling tinggi dari ketiga senyawa tersebut adalah alkohol. Kenapa alkohol lebih tinggi titik didihnya dari pada yang lainnya? Karena alkohol itu sendiri dengan alkohol yang lain dapat membentuk ikatan hidrogen, sedangkan propanon dengan propanon lainnya tidak dapat membentuk iktan hidrogen lainnya.
Selanjutnya berdasarkan kelarutannya bahwa untuk senyawa alkanon yang mempunyai Mr rendah itu akan bisa larut dalam air. Hal tersebut dikarenakan mempunyai ikatan hidrogen yang terbentuk. Sehingga dapat disimpulkan bahwa aldehid dan keton merupakan senyawa polar, karena bersifat polar maka reaksinya akan mudah bereaksi.
Lalu bagaimana, apa perbedaan yang terjadi antara C=C yang merupakan bersifat non polar sedangkan C=O merupakan senyawa karbonil yang bersifat polar?
Jika pada senyawa karbonil, dimana diketahui bahwa O nya itu akan lebih elektronegatif sedangkan C akan lebih elektropositif sehingga dengan demikian ketika adanya reaksi apabila sebuah nukleofil yang bereaksi maka nukleofilnya akan menuju kearah C. namun sebaliknya nanti ketika yang bereaksi itu adalah sebuah elektrofil yang kekurangan elektron maka yang bereaksi dan melakukan penyerangan adalah atom oksigen. Bagaiman reaksi aldehid dan keton pada umumnya? Coba perhatikan gambar dibawah ini:
Bahwa reaksi aldehid dan keton diawali dengan protonasi, dimana dapat dilihat atom O nya akan melakukan penyerangan terhadap protonnya sehingga nanti akan terbentuknya reaksi. Kemudian akan dilanjutkan dengan reaksi berikutnya dengan reaksi nukleofil, dimana nukleofilnya akan melakukan penyerangan terhadap atom C sehingga atom C lebih positif sehingga terbentuknya reaksi.
Dapat disimpulkan bahwa umumnya karbonil itu selalu saja diawali dengan protonasi, setelah proton diikat maka baru nukleofilnya akan melakukan penyerangan terhadap C nya sehinnga nukleofilnya akan terikat. Dapat dilihat bahwa itu merupakan reaksi adisi, hal tersebut dikarenakan yang awalnya ikatan rangkap kemudian berubah menjadi ikatan tunggal.
Mekanisme reaksi adisi nukleofilik sebagai berikut:
1. Reaksi Hidrat ( reakasi dengan air)
Dapat dilihat dari gambar diatas bahwa gugus C=O harus di protonasi dengan H+ akan menjadi OH dan muatannya menjadi positif. Dapat dilihat bahwa elektronnya di C akan bergeser kearah O sehingga C nya akan menjadi elektronpositif maka ketika elektron C nya positif dapat diserang oleh nukleofil (H2O) yaitu O akan berikatan dengan C. Nah hasilnya adalah O nya akan bermuatan positif sehingga akan melepaskan H+ akibatnya C akan mengikat OH dan OH. Apa itu hidrat? Yaitu OH terikat pada C yang sama. Dapat dilihat bahwa reaksi tersebut merupakan rekasi reversible, dimana reaksi reversible merupakan reaksi yang kurang stabil.
2. Reaksi dengan alkohol ( hemiasetal dan asetal)
Pembentukan reaksi dengan alkohol terbagi menjadi dua yaitu hemiasetal jika mengikat hanya satu ROH saja sedangkan yang kedua yaitu asetal jika mengikat lebih dari sati ROH ( mengikat 2 ROH). Dapat dilihat gambar dibawah ini:
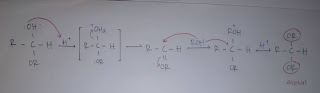
Dapat dilihat bahwa selalu saja hal pertama yaitu dilakukan protonasi, sehingga membentuk OH dimana O nya akan bermuatan positif sehingga elektron C akan bergeser kea rah O menjadi C nya lebih elektronpositif. Maka dengan C nya elektronpositif membuat nukleofilnya dapat menyerang atom C. Maka akan terbentuknya OR dan O akan bermuatan positif sehingga akan melepaskan H+ akibatnya akan menghasilkan senyawa dimana C nya mengikat OH dan OR. Adapaun dari reaksi tersebut dapat disebut sebagai hemiasetal karena itu untuk mengikat satu ROH. Bagaimana jika mengikat dua ROH? Coba perhatikan gambar dibawah ini:
Adapun cara nya sama dengan langkah sebelumnya yaitu adanya protonasi. Lalu manakah yang akan di protonasi OH atau OR? Maka yang akan diprotonasi adalah OH. Hal tersebeut dikarenakan jika OR di protonasi maka akan kembali seperti awal lagi makanya yang diprotonasi adalah OH. Sehingga ketika OH nya diprotonasi maka akan terbentuk OH2 yang bermuatan positif, dimana OH2 tersebut merupakan gugus yang mudah pergi karena gugus pergi yang baik. Maka ketika OH nya lepas maka elektron dari O itu akan bisa mengisi posisi dari C-R, C-O sehingga membentuk C=OR yaitu membentuk ikatan rangkap. Dengan adanya ikatan rangkap tersebut maka C nya akan terjadi pergeseran dimana ikatan rangkap O akan ke O. sehingga C nya akan menjadi lebi positif dan ROH nya akan melakukan penyerangan terhadap C nya. Adapun akibat dari penyerangan tersebut maka C nya akan mengikat ROH dan OR. Selanjutnya H nya dilepas terbentuknya C yang mengikat OR dan OR. Jadi dapat dilihat bahwa jika reaksi berlanjut maka akan menghasilkan reaksi asetal ( apabila reaksi dilanjutnya dengan mereaksi ROH kembali maka akan menghasilkan reaksi asetal).
3. Reaksi dengan Hidrogen sianida
Hidrogen sianida merupakan asam lemah, biasanya reaksinya dalam suasa basa. Jika dalam suasa basa akan menghasilkan H2O dan CN-. Dan CN- ini lah yang akan bereaksi nantinya. Jika sebelumya kita sudah mengenal reaksi H2O dan ROH, dimana kedua senyawa tersebut merupakan nukleofil lemah maka jika nukleofilnya lemah membutuhkan protonasi sedangkan CN- seperti yang diketahui bahwa merupakan nukleofil kuat sehingga tidak perlu protonasi. Coba perharikan gambar dibawah ini:
CN- akan langsung melakukan penyerangan terhadap gugus yang lebih posistig yaitu C, dengan demikian CN- akan berpindah dan elektron dari akan bergeser membentuk O- . sedangkan O- merupakan alkoksida yaitu basa yang kuat maka akan bereaksi dengan asam yang lemah (HCN) sehingga kan mengikat H dan akibat yang terjadi C mengikat OH dan CN (sianohidrid).
Permasalahan:
1. Reaksi hidrat adalah reaksi reversible yang merupakan reaksi yang kurang stabil. Jika reaksi hidrat tidak stabil, bagaimana cara untuk menstabilkannya dan faktor apa saja yang dapat mensabilkannya?
2. Pada reaksi dengan alkohol terdapat 2 yaitu hemiasetal dan asetal. Bagaiman kepolaran yang terjadi ketika hemiasetal mengikat ROH yang membentuk karbonil mengikat OR dan OH sedangkan asetal mengikat 2 ROH yang mana karbonilya mengikat 2 OR?
3. Pada reaksi dengan alkohol, dimana ketika OH diprotonasi pada reaksi asetal sehingga terbentuknya OH2 atau H2O yang merupakan gugus pergi yang baik. Bagaimana OH2 atau H2O dapat dikatakan gugus pergi yang baik, padahal diketahui bahwa OH2 atau H2O merupakan nukleofil lemah dan faktor apa yang menyebabkan OH2 atau H2O dapat dikatakan gugus pergi yang baik?

















Baiklah perkenalkan nama saya Zainuddin Azhim Nim A1C119007 akan mencoba menjawab permasalahan no 2
BalasHapusMenurut saya, hal itu terjadi karna gugus OH pada hemiasetal sangat rentan untuk di ganggu oleh H+ sehingga membentuk senyawa hemiasetal terprotonasi dan tidak stabil sehingga harus di lanjutkan dengan penambahan alkohol sehingga di dapatkan asetal. Pada hemi asetal masih terdapat OH bebas dimana OH ini dapat bereaksi dengan alkohol dengan menggunakan katalis H+ dan membentuk suatu asetal dengan produk samping H2O.
Terimakasih🙏
Baiklah perkenalkan nama saya Zainuddin Azhim Nim A1C119007 akan mencoba menjawab permasalahan no 2
BalasHapusMenurut saya, hal itu terjadi karna gugus OH pada hemiasetal sangat rentan untuk di ganggu oleh H+ sehingga membentuk senyawa hemiasetal terprotonasi dan tidak stabil sehingga harus di lanjutkan dengan penambahan alkohol sehingga di dapatkan asetal. Pada hemi asetal masih terdapat OH bebas dimana OH ini dapat bereaksi dengan alkohol dengan menggunakan katalis H+ dan membentuk suatu asetal dengan produk samping H2O.
Terimakasih🙏
saya Sucitra Dwi Sanjaya (A1C119019) izin menjawab permasalahan blog riska nomor 1
BalasHapusDapat dilihat dari gambar diatas bahwa gugus C=O harus di protonasi dengan H+ akan menjadi OH dan muatannya menjadi positif. Dapat dilihat bahwa elektronnya di C akan bergeser kearah O sehingga C nya akan menjadi elektronpositif maka ketika elektron C nya positif dapat diserang oleh nukleofil (H2O) yaitu O akan berikatan dengan C. Nah hasilnya adalah O nya akan bermuatan positif sehingga akan melepaskan H+ akibatnya C akan mengikat OH dan OH. Apa itu hidrat? Yaitu OH terikat pada C yang sama. Dapat dilihat bahwa reaksi tersebut merupakan rekasi reversible, dimana reaksi reversible merupakan reaksi yang kurang stabil.
terimakasih
baiklah saya Sindy Putri Edyana NIM A1C119010 ingin mencoba menjawab permasalahan no 3.
BalasHapusH2O gugus pergi yang lebih baik dari –OH karena H2O adalah basa yang lebih lemah. Lebih dari itu pada tren periodik pada kebasaan sekarang dapat digunakan untuk mengidentifikasi tren periodic pada kemampuan gugus pergi:
- Dari kiri ke kanan panah pada tabel periodik , kebasaan menurun begitu kemampuan gugus pergi meningkat.
- Kebawah kolom pada tabel periodik, kebasaan menurun begitu kemampuan gugus pergi meningkat.
dan Seluruh gugus pergi yang baik adalah basa lemah dengan asam konjugasi kuat memiliki nilai pKa yang kecil.
terimakasih